جدول تناوبي عنصرهاي شيميايي (به انگليسي:Periodic table يا periodic table of elements)، نمايش جدولي عنصرهاي شيميايي بر پايهٔ عدد اتمي،آرايش الكتروني و ويژگيهاي شيميايي آنها است. ترتيب جايگيري عنصرها در اين جدول از عدد اتمي (شمار پروتونهاي) كمتر به سوي عدد اتمي بالاتر است. شكل استاندارد اين جدول ۱۸ × ۷ است؛ عنصرهاي اصلي در بالا و دو رديف كوچكتر از عنصرها در پايين جاي دارد. ميتوان اين جدول را به چهار مستطيل شكست، اين چهار بلوك مستطيلي عبارتند از: بلوك اس در سمت چپ، بلوك پي در راست، بلوك دي (فلزات واسطه) در وسط و بلوك اف(فلزات واسطهٔ داخلي) در پايين. رديفهاي اين جدول،دوره و ستونهاي آن، گروههاي جدول تناوبي نام دارند. همچنين گاهي برخي از اين گروهها نامهاي ويژهاي دارند. براي نمونه گروه هالوژنها و گازهاي نجيب از آن جملهاند. هدف از ساخت جدول تناوبي، چه به شكل مستطيلي و چه به شكلهاي ديگر، بررسي بهتر ويژگيهاي شيميايي عنصرها بودهاست. اين جدول، كاربرد زيادي در دانش شيمي و پردازش رفتار عنصرها دارد.
جدول تناوبي با نام ديميتري مندليف شناخته شدهاست، با اينكه پيشروان ديگري پيش از او وجود داشتهاند. او اين جدول را در سال ۱۸۶۹ منتشر كرد. اين، نخستين جدولي بود كه به اين گستردگي مرتب شده بود. مندليف اين جدول را تهيه كرد تا ويژگيهاي دورهاي آنچه كه بعدها «عنصر» نام گرفت را بهتر نشان دهد. وي توانسته بود برخي ويژگيهاي عنصرهايي كه هنوز كشف نشده بود را پيشبيني كند و جاي آنها را خالي گذاشته بود.[۱] كمكم با پيشرفت دانش، عنصرهاي تازهاي شناسايي شد و جاي خالي عنصرها در جدول پُر شد. با شناسايي عنصرهاي نو و گسترش شبيهسازيهاي نظري دربارهٔ رفتار شيميايي مواد، جدول آن روز مندليف بسيار گستردهتر شدهاست.
همهٔ عنصرهاي شيميايي از عدد اتمي ۱ (هيدروژن) تا ۱۱۸ (اوگانسون) شناسايي يا ساخته شدهاند. دانشمندان هنوز به دنبال ساخت عنصرهاي پس از اوگانسون هستند و البته اين پرسش را پيش رو دارند كه عنصرهاي تازهتر چگونه جدول را اصلاح خواهند كرد. همچنين ايزوتوپهاي پرتوزاي بسياري هم در آزمايشگاه ساخته شدهاست.
عنصرها در جدول تناوبي به صورت افقي (چپ به راست) در دورههاي ۱ تا ۷ و به صورت عمودي (بالا به پايين) در گروههاي ۱ تا ۱۸ دستهبندي ميشوند. همچنين دستهبندي ديگري بر اساس لايهٔ الكتروني در حال پر شدن وجود دارد كه بر اساس آن، عنصرها در بلوكهاي s و p و d و f قرار ميگيرند.
يك گروه يا خانواده، يك ستون عمودي از جدول تناوبي است. عنصرهاي يك گروه معمولاً ويژگيهاي نزديك به هم بيشتري نسبت به عنصرهاي يك دوره يا بلوك دارند. دانش مكانيك كوانتوم كه دربارهٔ ساختار اتمي پژوهش ميكند، نشان ميدهد كه چون عنصرهاي موجود در يك گروه همگي از آرايش الكتروني يكساني در لايهٔ آخر الكترونيبرخوردارند؛[۸] بنابراين ويژگيهاي شيميايي مشابهي از خود نشان ميدهند و هرچه عدد اتمي آنها بالاتر ميرود، اين مشابهتها افزايش پيدا ميكند.[۹] با اين حال گاهي در بلوك d و f هماننديهاي عنصرهاي يك دوره به اندازهٔ هماننديها در يك گروه مهم هستند. به همانندي (شباهت) در يك دوره، همانندي افقي و در يك گروه، همانندي عموديگفته ميشود.[۱۰][۱۱][۱۲]
بر اساس يك قرارداد جهاني، گروهها از ۱ تا ۱۸ شمارهگذاري شدهاند كه گروه شمارهٔ يك را نخستين گروه از چپ (فلزهاي قليايي) و آخرين گروه را گروه نخست از راست (گازهاي نجيب) در نظر گرفتهاند.[۱۳] در گذشته، شمارهٔ گروهها را با عددهاي رومي نشان ميدادند. همچنين در آمريكا براي گروههاي بلوك اس و پي يك حرف A و براي عنصرهاي بلوك دي يك حرف B در كنار شمارهٔ رومي گروه ميگذاشتند. براي نمونه گروه چهار به صورت IVB و گروه چهاردهم (يا عنصرهاي گروه كربن) به صورت IVA نمايش داده ميشد. در اروپا هم همين روش به كار ميرفت، با اين تفاوت كه حرف A براي گروههاي پيش از گروه ۱۰ و حرفB براي عنصرهاي گروه ۱۰ و گروههاي پس از آن بكار ميرفت. در سال ۱۹۸۸ آيوپاك سامانهٔ نامگذاري تازهاي را پيشنهاد كرد و روشهاي پيشين همگي فراموش شد.[۱۴]
| گروه | نام |
|---|---|
| ۱ | فلزهاي قليايي |
| ۲ | فلزهاي قليايي خاكي |
| ۱۱ | فلزهاي سكه |
| ۱۲ | فلزهاي فرار (كم كاربرد) |
| ۱۳ | گروه بور |
| ۱۴ | گروه كربن |
| ۱۵ | گروه نيتروژن |
| ۱۶ | كالكوژنها |
| ۱۷ | هالوژنها |
| ۱۸ | گاز نجيب |
ويژگيهاي عنصرهاي يك گروه مانند شعاع اتمي، انرژي يونش و الكتروندوستي مشابه يكديگر هستند. از بالا به پايين، شعاع اتمي عنصرها افزايش مييابد، در نتيجه الكترونهاي لايهٔ آخر در فاصلهٔ دورتري از هسته جاي ميگيرند، چون ترازهاي انرژي بيشتري پُر شدهاند. از بالا به پايين، انرژي يونش كاهش مييابد. چون الكترونها كمتر به هسته پيوند خوردهاند و آسانتر ميتوان آنها را جدا كرد. با تحليل مشابه، از بالا به پايين الكتروندوستي عنصرها كاهش مييابد. چون فاصلهٔ ميان الكترونهاي لايهٔ آخر و هسته افزايش مييابد.[۱۵] البته در اين ميان استثناهايي هم وجود دارد. براي نمونه در گروه ۱۱الكتروندوستي از بالا به پايين افزايش مييابد.[۱۶]
دورهويرايش
يك دوره در جدول تناوبي، يك رديف افقي از اين جدول است. با اينكه عنصرها در يك گروه هماننديهاي بسياري دارند، اما بخشهايي از دورهها هستند كه از اهميتي بيش از گروهها برخوردارند. مانند بلوك F، جايي كه لانتانيدها وآكتينيدها دو مجموعهٔ افقي از عنصرهاي جدول را ميسازند.[۱۷]
عنصرها در يك دوره هماننديهايي از لحاظ شعاع اتمي، انرژي يونش، الكتروندوستي و الكترونخواهي (مقدارانرژي آزاد شده هنگامي كه يك الكترون به يك مولكول يا اتم خنثي افزوده ميشود) از خود نشان ميدهند. در يك دوره از چپ به راست، شعاع اتمي كاهش مييابد. اين پديده، به اين دليل است كه با افزايش عدد اتمي در يك دوره، شمار لايههاي الكتروني ثابت است، اما شمار پروتونها افزايش مييابد. براي همين الكترونها بيشتر به سوي هسته كشيده ميشوند.[۱۸] كاهش شعاع اتمي باعث افزايش انرژي يونش ميشود (از چپ به راست). هرچه پيوندها در يك عنصر محكمتر باشد، انرژي بيشتري هم براي جداسازي يك الكترون نياز است. الكتروندوستيمانند انرژي يونش رفتار ميكند و از چپ به راست افزايش مييابد. چون كشش هسته بر روي الكترونها افزايش مييابد.[۱۵] همچنين مقدار الكترونخواهي هم در طول يك دوره اندكي تغيير ميكند. فلزها (عنصرهاي سمت چپ دوره) معمولاً نسبت به نافلزها (سمت راست دوره) الكترونخواهي پايينتري دارند. اين قانون براي گازهاي نجيب برقرار نيست.[۱۹]
بلوكويرايش
چون لايهٔ آخر الكتروني از اهميت ويژهاي برخوردار است، جدول تناوبي به بخشهايي وابسته به اين لايههاي الكتروني تقسيم شدهاست. به هر يك از اين بخشها يك بلوك ميگويند.[۲۰] بلوك اس دربردارندهٔ دو گروه نخست جدول (فلزهاي قليايي و قليايي خاكي) و دو عنصرهيدروژن و هليم است. بلوك پي دربردارندهٔ شش گروه آخر جدول، گروههاي ۱۳ تا ۱۸ آيوپاك (۳A تا ۸A در نامگذاري آمريكايي) است. همهٔ شبهفلزات و نافلزها در اين بلوك جاي ميگيرند. بلوك دي دربردارندهٔ گروههاي ۳ تا ۱۲ آيوپاك (۳B تا ۸B در نامگذاري آمريكايي) و همهٔ فلزات واسطه است. بلوك اف كه بيشتر در پايين بدنهٔ اصلي جدول جاي ميگيرد دربردارندهٔ لانتانيدها و اكتينيدها است.[۲۱]
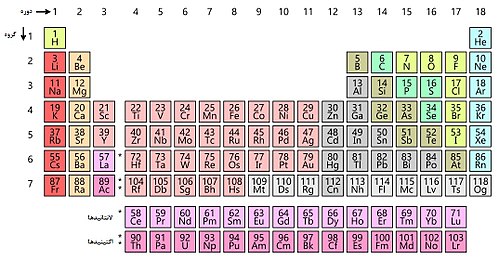
 آشنايي با جدول دوره اي عناصر
آشنايي با جدول دوره اي عناصر ذرات زير اتمي
ذرات زير اتمي